2.1.3 Propiedades químicas y su variación periódica: tendencias generales y por grupo.
2.1.3 PROPIEDADES QUÍMICAS Y SU VARIACIÓN PERIÓDICA: TENDENCIAS GENERALES Y POR GRUPO.
- PROPIEDADES
- VARIACIÓN PERIÓDICA
- METALES, NO METALES Y METALOIDES
- TIPOS DE METALES
1. propiedades químicas:
Son las que hacen al cambio de composición de la materia. La exposición de cualquier materia a una serie de reactivos o de condiciones particulares puede generar una reacción química en la materia y cambiar su estructura. A continuación se ejemplifican y explican algunos ejemplos de propiedades químicas de la materia:
 Ph. Propiedad química que sirve para medir la acidez de una sustancia o disolución.
Ph. Propiedad química que sirve para medir la acidez de una sustancia o disolución. Combustión. La oxidación rápida, que se produce con desprendimiento de calor y de luz.
Combustión. La oxidación rápida, que se produce con desprendimiento de calor y de luz. Estado de oxidación. Grado de oxidación de un átomo.
Estado de oxidación. Grado de oxidación de un átomo. Poder calorífico. Cantidad de energía que se desprende al producirse una reacción química.
Poder calorífico. Cantidad de energía que se desprende al producirse una reacción química. Estabilidad química. Capacidad de una sustancia de evitar reaccionar con otras.
Estabilidad química. Capacidad de una sustancia de evitar reaccionar con otras. Alcalinidad. Capacidad de una sustancia para neutralizar ácidos.
Alcalinidad. Capacidad de una sustancia para neutralizar ácidos. Corrosividad. Grado de corrosión que puede ocasionar una sustancia.
Corrosividad. Grado de corrosión que puede ocasionar una sustancia. Inflamabilidad. Capacidad de una sustancia de iniciar una combustión al aplicársele calor a suficiente temperatura.
Inflamabilidad. Capacidad de una sustancia de iniciar una combustión al aplicársele calor a suficiente temperatura. Reactividad. Capacidad de una sustancia para reaccionar en presencia de otras.
Reactividad. Capacidad de una sustancia para reaccionar en presencia de otras. Potencial de ionización. Energía necesaria para separar a un electrón de un átomo.
Potencial de ionización. Energía necesaria para separar a un electrón de un átomo.
- 2. Carga nuclear efectiva
- La carga nuclear efectiva es la carga positiva neta experimentada por un electrón en un átomo poli electrónico. El término "efectiva" se usa porque el efecto pantalla de los electrones más cercanos al núcleo evita que los electrones en orbitales superiores experimenten la carga nuclear completa. Es posible determinar la fuerza de la carga nuclear observando el número de oxidación del átomo. En un átomo con un electrón, el electrón experimenta toda la carga del núcleo positivo. En este caso, la carga nuclear efectiva puede ser calculada usando la ley de Coulomb. Sin embargo, en un átomo con muchos electrones, los electrones externos son, simultáneamente, atraídos al núcleo debido a su carga positiva, y repelidos por los electrones cargados negativamente. La carga nuclear efectiva en un electrón de este tipo de átomo está dada por la siguiente ecuación:
3. Radio atómico y radio iónico
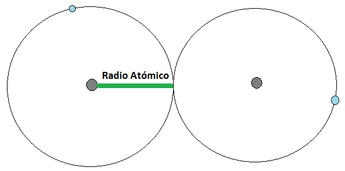
- Se define como la distancia media que existe entre los núcleos atómicos de dos átomos que se encuentren unidos mediante un enlace (los enlaces atómicos se verán en detalle un poco más adelante). Para los átomos que se unan mediante una cesión de electrones, el radio atómico corresponde a la distancia indicada en la Imagen 1 mientras que los que se unan mediante una compartición de electrones, el radió atómico se representa tal y como aparece en la Imagen 2.
Radio Atómico. Las pelotas grises son los núcleos atómicos, mientras las bolas celestes son el electrón mas externo
1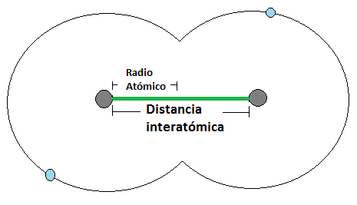 2
2
Direcciones hacia donde aumenta el Radio Atómico.
 2
2Direcciones hacia donde aumenta el Radio Atómico.
Radio Iónico: El radio iónico se define en relación a iones. Un ion es una especie química con carga, ya sea esta positiva o negativa, y se originan debido a que los elementos tratan de parecerse al gas noble más cercano (elementos del grupo 18), ya que estos tienen una estabilidad superior debido a que sus niveles energéticos se encuentran completos. El término ion significa "ir hacia" y hace referencia a un circuito eléctrico, es por eso que las sustancias cargadas positivamente se llaman cationes (van hacia el cátodo, polo negativo) y las sustancias cargadas negativamente se llaman aniones (van hacia el ánodo, polo positivo). Pero, ¿qué hace que exista esta especie química cargada? La respuesta es la ganancia o pérdida de electrones. Como un átomo es eléctricamente neutro, cuando, por ejemplo, gana un electrón de más queda con cargado con un -1 mientras que si pierde un electrón queda cargado con un +1. La capacidad de un átomo para ganar o perder electrones está dado por su electronegatividad, electropositividad, energía de ionización y electroafinidad (propiedades que se verán más adelante). El radio iónico de una especie que ha perdido un electrón es menor que el radio atómico original, esto se debe a que como existe una carga positiva más que negativa, los electrones se sienten mucho más atraídos hacia el núcleo, reduciendo el radio. Por su parte, cuando un elemento gana un electrón, su radio iónico es mayor que su radio atómico de origen, debido a que ese último electrón que entró no se encuentra tan atraído hacia el núcleo y hace aumentar el radio. El radio iónico, al igual que su par atómico, aumenta a medida que se "baja" en un grupo, pero a diferencia del radio atómico, no presenta una tendencia clara de crecimiento en un periodo, ya que depende del ion (y algunos elementos tienen más de un ion posible, como Cu, Fe, Mn, etc.).
4. Energía de ionización
La Energía de Ionización Ei (también llamada Potencial de Ionización) es la energía necesaria para arrancar el electrón más externo de un elemento en estado gaseoso:
La Energía de Ionización se puede medir en:


Existen átomos que presentan capas de valencia con lugares vacantes o "huecos", que pueden ser ocupados por electrones. Entonces cuando a un átomo neutro se le añaden uno o más electrones se presenta un desprendimiento de energía, conocida como afinidad eléctrica, obteniéndose como resultado la formación de aniones. Aunque la magnitud de dicha energía liberada sólo puede determinarse indirectamente y muy rara vez con gran exactitud, en la tabla periódica la podemos predecir en orden ascendente en un mismo período, de izquierda a derecha, y en un mismo grupo, de abajo hacia arriba.

Las propiedades químicas de los elementos dependen de la distribución electrónica en los diferentes niveles, por ello; todos aquellos que tienen igual número de electrones en su último nivel presentan propiedades químicas similares, correspondiendo el número de período en que se encuentra ubicado, al del último nivel con electrones y el número de grupo guarda relación con la cantidad de electrones en la última capa . La tabla periódica puede dividirse en diversas formas según las propiedades que se deseen estudiar, de tal suerte que se agrupan conjuntos de elementos con características comunes.


A(g) + Ei → A+(g) + e-
Donde:- A(g) es un elemento cualquiera en estado gas
- A+(g) ion del elemento al que se le arranca un electrón
La Energía de Ionización se puede medir en:
- Electrón-voltios por átomo (eV/átomo)
- Kilocalorías por mol (kcal/mol)
- Kilojulios por mol (KJ/mol)
- Potencial de ionización: es el potencial en voltios (V) necesario para arrancar el electrón

5. Propiedades de la Energía de Ionización:
- Radio Atómico: la Energía de Ionización varía inversamente con el Radio atómico, puesto que cuanto más pequeño sea el radio atómico, más alta será la atracción del núcleo sobre el electrón
- La Ei aumenta de izquierda a derecha en la Tabla Periódica al disminuir el radio atómico
- La Ei aumenta de abajo arriba en la Tabla Periódica al estar el último electrón en capas más cercanas al núcleo
- Segunda Energía de Ionización: es mayor que la primera ya que la fuerza electrostática que soporta el electrón es mayor: Ei (A+→ A+2) > Ei (A → A+). Asimismo la tercera energía de ionización sería también mayor y así sucesivamente.
- Apantallamiento: los electrones de capas inferiores pueden interferir sobre el electrón exterior (efecto pantalla) produciendo irregularidades en le Energía de Ionización.
- Alcalinos: Los elementos alcalinos (Primer Grupo o Columna) poseen la menor Energía de Ionización
- Gases Nobles: poseen la mayor Energía de Ionización ya que su última capa está completa (configuración electrónica estable)
- Grupo del Boro: los elementos de este grupo (Boro, Aluminio, Galio, Indio y Talio) presentan una anomalía a las reglas anteriores ya que su valor es inferior. Esto es debido a que en este grupo comienzan a rellenarse los orbitales p (menos atraídos al núcleo que los s)
- Grupo del Oxígeno: también presentan una Energía de Ionización ligeramente menor debido en este caso a un efecto de repulsión entre electrones que ocupan un mismo orbital
6. Afinidad electrónica
La afinidad eléctrica, afinidad electrónica o AE es la energía intercambiada cuando un átomo neutro, gaseoso, y en su estado fundamental, capta un electrón y se convierte en un ion mono negativo
La afinidad electrónica es la cantidad de energía absorbida por un átomo aislado en fase gaseosa para formar un ión con una carga eléctrica de −1. Si la energía no es absorbida, sino liberada en el proceso, la afinidad electrónica tendrá, en consecuencia, valor negativo tal y como sucede para la mayoría de los elementos químicos; en la medida en que la tendencia a adquirir electrones adicionales sea mayor, tanto más negativa será la afinidad electrónica. De este modo, el flúor es el elemento que con mayor facilidad adquiere un electrón adicional, mientras que el mercurio es el que menos.
Aunque la afinidad eléctrica parece variar de forma caótica y desordenada a lo largo de la tabla periódica, se pueden apreciar patrones. Los no metales tienen afinidades electrónicas más bajas que los metales, exceptuando los gases nobles que presentan valores positivos por su estabilidad química, ya que la afinidad electrónica está influenciada por la regla del octeto. Los elementos del grupo 1, tienden a ganar un electrón y formar aniones −1, completando el subnivel s, mientras que los elementos del grupo 2, que ya lo tienen completo, no presentan esa tendencia. Análogamente sucede en el bloque p, donde las afinidades electrónicas se van haciendo más negativas a medida que nos acercamos a los gases nobles.

7 Electronegatividad
La electronegatividad, es una propiedad química que mide la capacidad de un átomo (o de manera menos frecuente un grupo funcional) para atraer hacia él los electrones, o densidad electrónica, cuando forma un enlace covalente en una molécula. También debemos considerar la distribución de densidad electrónica alrededor de un átomo determinado frente a otros, tanto en una especie molecular como en un compuesto no molecular.
Variación periódica
Las electronegatividades de los elementos representativos aumentan de izquierda a derecha a lo largo de los periodos y de abajo a arriba dentro de cada grupo. Las variaciones de electronegatividades de los elementos de transición no son tan regulares. En general, las energías de ionización y las electronegatividades son inferiores para los elementos de la zona inferior izquierda de la tabla periódica que para los de la zona superior derecha.
El concepto de la electronegatividad es muy útil para conocer el tipo de enlace que originarán dos átomos en su unión: El enlace entre átomos de la misma clase y de la misma electronegatividad es apolar. Cuanto mayores sean las diferencias de electronegatividad entre dos átomos tanto mayor será la densidad electrónica del orbital molecular en las proximidades del átomo más electronegativo. Se origina un enlace polar. Cuando la diferencia de electronegatividades es suficientemente alta, se produce una transferencia completa de electrones, dando lugar a la formación de especies iónicas. Los metales son de baja electronegatividad por lo que tienden a regalar electrones para formar iones positivos, y los no metales son menos electronegativos, por eso forman iones negativos. Al conoce la electronegatividad de los elementos se puede predecir fácilmente el modelo de enlace que formaran (iónico, covalente, coordinado, polar y no polar); cuanto mas fuerte sea el enlace, tanto mayor será la diferencia de electronegatividades.
Ejemplo: el potasio, es un átomo que presenta muy poca afinidad por los electrones. Posee una electronegatividad de tan solo 0.8 mientras que el silicio(Si), cuya afinidad de los electrones es moderada, tiene una electronegatividad de 1.8
Los elementos al combinarse entre si intercambian o seden electrones, de tal manera que alcanzan la configuración electrónica semejante a la de un gas noble, formando de esta manera lo que llamamos enlace químico.

- METALES, NO METALES Y METALOIDES
Aún antes de establecerse la tabla periódica; ya el creador de la SIMBOLOGIA de los elementos J. J. BERZELIUS publicó en 1814 una clasificación sistemática en donde agrupaba dos tipos: los METALES y los NO METALES.
Las características de los elementos METALICOS son:
- Conducen con facilidad el calor y la electricidad.
- Presentan brillo metálico
- Generalmente pueden ser laminados o estirados formando alambres, propiedades que se conocen como MALEABILIDAD y DUCTILIDAD.
- Por lo regular a temperatura ambiente son sólidos excepto Hg, Ga, Cs y Fr.
- Al combinarse con NO METALES ceden electrones por lo que adquieren cargas positivas (CATIONES).
Los NO METALES presentan las siguientes características:
- Son malos conductores del calor y la electricidad.
- No son maleables ni dúctiles.
- Reciben electrones al combinarse con los METALES adquiriendo así cargas NEGATIVAS (ANIONES).
Algunos elementos suelen comportarse según las condiciones como metales o como no metales; a estos se les conoce como METALOIDES.
- Tipos de metales
Metales alcalinos
Los metales alcalinos incluyen a los elementos del grupo 1, desde el Litio (Li) hasta el Francio (Fr). El Hidrógeno está en el grupo 1 pero no es un metal alcalino, de hecho el hidrógeno muestra muy pocas características metálicas y es frecuentemente categorizado como un no metal.
Metales alcalinotérreos
Los metales alcalinotérreos coinciden con el grupo 2, desde el berilio (Be) hasta el radio (Ra). Suelen tener un punto de fusión muy alto y sus compuestos óxidos forman soluciones alcalinas muy básicas.
Lantánidos
Los lantánidos son el grupo formado desde el elemento con número atómico 57, el lantano (La), que le da nombre al grupo, hasta el elemento de número atómico 71, el Lutecio (Lu). La capa de valencia de los lantánidos es 4f; junto a los actínidos (5f) forman el bloque f.
Actínidos
Los actínidos es el grupo que comprende desde el número atómico 89, el Actinio (Ac), hasta el 103, el Lawrencio (Lr). La capa de valencia es 5f y son todos son radioactivos. Son elementos poco abundantes, de hecho solo el torio (Th) y el uranio (U) se dan en la naturaleza en cantidades significativas.
Metales de transición
Los metales o elementos de transición se sitúan en el centro de la tabla periódica,en el bloque d, que abarca desde el grupo 3 al grupo 12. Se caracterizan por tener un orbital d parcialmente ocupado en su configuración electrónica.
Metales postransicionales
Los metales postransicionales, a veces referidos simplemente como “otros metales”, son el Aluminio (Al), Galio (Ga), Indio (In), Talio (Tl), Estaño (Sn), Plomo (Pb) y Bismuto (Bi). Estos elementos se consideran metales pero suelen tener características metálicas más moderadas; por ejemplo, suelen ser más blandos o relativamente peores conductores.
Metaloides
Los metaloides son sustancias con propiedades intermedias entre los metales y los no metales. Se comportan típicamente como no metales, pero pueden presentar aspectometálico o conducir la electricidad en algunas circunstancias. Los elementos metaloides, también conocidos como semimetales, son el Boro (B), Silicio (Si), Germanio (Ge), Arsénico (As), Antimonio (Sb), Telurio (Te) y Polonio (Po); a veces se incluye también al Astato (At).
No metales
Bajo el término “no metales” se englobarían a todos los demás elementos, desde los halógenos a los gases nobles, pero es muy frecuente que se utilice para elementos no metálicos que no se pueden clasificar como halógenos ni como gases nobles, es decir, para Hidrógeno (H), Carbono (C), Nitrógeno (N), Fósforo (P), Oxígeno (O), Azufre (S) y Selenio (Se).
Halógenos
Los halógenos son un tipo de elementos no metálicos que coinciden con el grupo 17 de la tabla periódica, lo que abarca desde el Flúor (F) hasta el Astato (At), este último a veces incluido en los metaloides. Los halógenos suelen ser elementos muy reactivos, por eso es común que se encuentren en la naturaleza formando parte de otras sustancias y rara vez en forma pura.
Gases nobles
Los conocidos como gases nobles coinciden con el grupo 18. Todos estos elementos son gaseosos en condiciones normales de presión y temperatura, no tienen color, no tienen olor, y su gran estabilidad les hace merecedores del adjetivo común de ser “inertes químicamente”

La tabla periódica es una representación gráfica de información sobre los elementos químicos, como el símbolo o el número atómico, en columnas y filas, es decir, en una disposición tabular. Si se lee de izquierda a derecha y de arriba a abajo, el número atómico es creciente. La masa atómica también es creciente en este sentido, salvo algunas excepciones.
Las filas de la tabla periódica se conocen como períodos. Se numeran del 1 al 7 en sentido descendente; el período 1 es el período superior y el período 7 es el inferior. A mayor período, es decir, al descender por la tabla periódica, aumenta el número de niveles energéticos del átomo en estado fundamental (no excitado).
Cada columna de la tabla periódica es un grupo y hay un total de 18. Los grupos se unen para formar 4 bloques en función del último orbital ocupado: s, p, d y f.

A los bloques S y P se les conoce como elementos REPRESENTATIVOS mientras que a los D y F se les denomina elementos de TRANSICIÓN EXTERNA e INTERNA respectivamente.
El bloque S está formado por dos columnas, el P por seis, en el D se observan diez y el F presenta un total de 14. Como se puede observar, el número de columnas corresponde al máximo de electrones que se pueden acomodar en esos tipos de orbitales, los elementos colocados en una misma columna o grupo tendrán igual cantidad de electrones en el nivel más externo y su electrón diferencial estará en el mismo tipo de orbital.




Comentarios
Publicar un comentario